A tüzelőanyag-cellák története
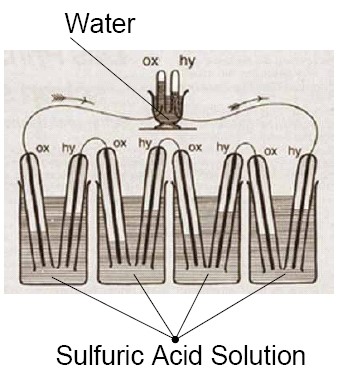
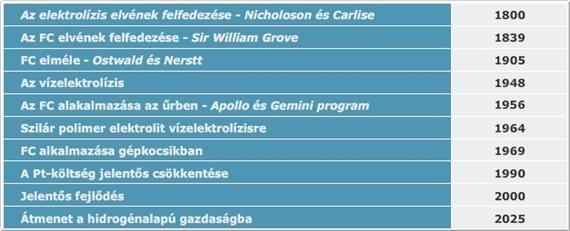
Sir William Robert Grove (1811–1896) 1838-ban vette észre azt, hogy ha vizet elektrolizál, az alkalmazott áram kikapcsolása után ellenkező irányú áram kezd el folyni. Ezt az áramot az okozza, hogy az egyik platinaelektródnál fejlődő hidrogén oxidálódik, míg a másiknál keletkező oxigén redukálódik a vízbontás megfordításával. Grove kihasználta a felfedezését, és megszerkesztette az első tüzelőanyag-cellát, amelyet – megkülönböztetésül a többi elemtől, amelyekben fémek és vegyületeik közötti reakció szolgáltatta az áramot – gázelemnek nevezett el. A gázelem két kénsavoldatba merülő platinaelektródból állt. Az egyik elektród a hidrogén-, a másik az oxigéntartályba nyúlt be. Grove azt is észrevette, hogy az oldatok szintje emelkedik, amikor áram folyik a két elektród között. Ez jelezte a hidrogén, illetve az oxigén fogyását. Bár a tüzelőanyag-cellát Grove találta fel, végül Ostwald magyarázta meg teljes körűen a működésüket. Bevezetve az elektród, az ion és az elektrokatalizátor fogalmait. Ő vezette be a félcella-reakciókat, azaz hogy a hidrogén oxidálódik, az oxigén redukálódik a Pt katalitikus felületén. A redoxifolyamatban keletkező elektronokat a külső körön munkára lehet fogni, míg az elektrolitban a hidrogénion vezeti a töltéseket (Grove-féle cella esetén). Ő vezette be a gázelektród és a hármas határfelület (triple-phase boundary) fogalmait, amelyeknek optimalizálása ma is a tüzelőanyag-cella kutatásának egyik lényeges eleme.
A Grove-féle gázelem tiszta hidrogénnel működött, és mivel az elektród síkelektród volt, nagy felületeteket kellett alkalmazni. Ezzel szemben Mond és Langer 1889-ben a hidrogént szénből állították elő (szintézisgáz). Tüzelőanyag-cellájukban 3 dimenziós pórusos elektródokat alkalmaztak, amivel 65A/m2 áramot tudtak elérni 0,73V-on. Azaz a XX. század elejére minden megvolt, amit ma is alkalmaznak a tüzelőanyag-cellákban. Ostwald tehát jogosan gondolta úgy, hogy a hőerőgépeket a magasabb hatásfokuk miatt felváltja az „elektrokémiai égetés” és a hidrogén egyetemes tüzelőanyag, a tüzelőanyag-cellák pedig a XX. század meghatározó energiatermelő egységei lesznek. A tüzelőanyag-cellákat először nem az energetikában, hanem az űrkutatásban kezdték alkalmazni. Bár a történet nem így indult…
Francis Bacon 1932-ben olvasott egy német cikket, amiben arról írtak, hogy a völgyidőszakokban feleslegben rendelkezésre álló elektromos energia segítségével vizet bontanának, és az így termelt hidrogént belső égésű motorokban égetnék el üzemanyagként. Bacon úgy gondolta, hogy sokkal jobb hatásfokot érnének el, ha elektrokémiailag termelnének áramot. Első javaslata „Energy storage battery” címmel az elektromos energia tárolásáról szólt, de végül nem kapott támogatást. Ekkor határozta el, hogy saját maga készíti el az első cellákat. A platinát, vélhetőleg magas ára miatt, elvetette és aktivált nikkelhálót használt vizes NaOH oldatban. Az elektródokat azbesztszövettel választotta el. A nikkel aktvitását 100°C feletti hőmérséklettel és magas nyomással kívánta növelni (210bar!). Mivel akkoriban gőzgépekkel foglalkozott, nem volt számára probléma megoldani a szigetelést ebben a nyomás- és hőmérséklet-tartományban. Először egy reverzibilis cellát tervezett, de végül kétcellás rendszert épített, ahol az egyiket vízbontásra a másikat elektromos áram termelésére használta. Végül a cellák 200°C-on és 42bar nyomáson üzemeltek. A tüzelőanyag-cella legnagyobb teljesítménye nem haladta meg a 100mA/cm2-et (jelenleg 1500mA/cm2 egy jobb cella teljesítménye) és több sebből is vérzett. Végül egy titkos kutatásból kapott egy pórusos nikkeldarabot, aminek a nagy felületével el lehetett érni a kívánt áramsűrűségeket. További probléma, amit meg kellett oldani, az a stabil határfelület biztosítása a hidrogén, az oxigén és az elektrolit között. Erre többpólusos elektródot fejlesztettek ki, ahol a gáz felőli oldal nagyobb, az elektrolit felőli oldal kisebb pólusokat tartalmazott, így pontosan tudták szabályozni a gázok behatolási mélységét.
Az instabil diafragmát úgy váltották ki, hogy minimálisan kisebb (0,14bar) nyomáskülönbséget alkalmaztak a gázok és az elektrolit között. A következő feladat a cella élettartalmának a növelése volt. Az oxigénelektróda ugyanis gyorsan oxidálódott, horpadás keletkezett rajta és végül összeesett. Rájöttek, hogy ha eloxálják a felületet, akkor az oxidréteg megóvja a nikkelt a további oxidálódástól. Azonban ekkor újabb probléma adódott, miszerint az oxidréteg elektromos szigetelőként viselkedett. Ezt a problémát is ki lehet küszöbölni, ha a réteget lítiummal doppolják. Már úgy tűnt, hogy az oxigén elektródproblémáinak a megoldásával a cella is jól fog működni, ekkor azonban a hidrogénoldal veszítette el az aktivitását. Rájöttek, hogy ezt az illesztésekből kioldódó katalizátorméreg okozza. Az oldódás megakadályozásához az illesztéseket teflonbevonattal látták el. Így végül az 50-es évek közepére elkészítették az első működő rendszert, ami 150W-ot szolgáltatott: 230mA/cm2 áramsűrűséget, 0,8V-os cellafeszültségekkel. Röviddel ezután figyeltek fel a találmányra az USA-ban, és végül a Prett&Whitney további 100 millió dollárt költött és 1000 mérnököt alkalmazott, hogy a demonstrációs modellből iparilag is hasznosítható termék legyen.
A Bacon-cella az űrkutatásban remekül bevált, ugyanis egyszerre szolgáltatott elektromos áramot, hőt és vizet az űrhajósok számára, ahol a tiszta hidrogén és oxigén folyamatosan rendelkezésre állt. A Bacon-cella későbbi ipari hasznosítására több kísérlet is történt, de végül földi alkalmazása nem hozott üzleti sikert.
A tüzelőanyag-cella típusainak bemutatása és csoportosítása
A tüzelőanyag-cellákat többféle szempont alapján lehet csoportosítani. A működési hőmérsékletük alapján a két fő típust különböztetünk meg:
- alacsonyhőmérsékletű és
- magas hőmérsékletű TC-k.
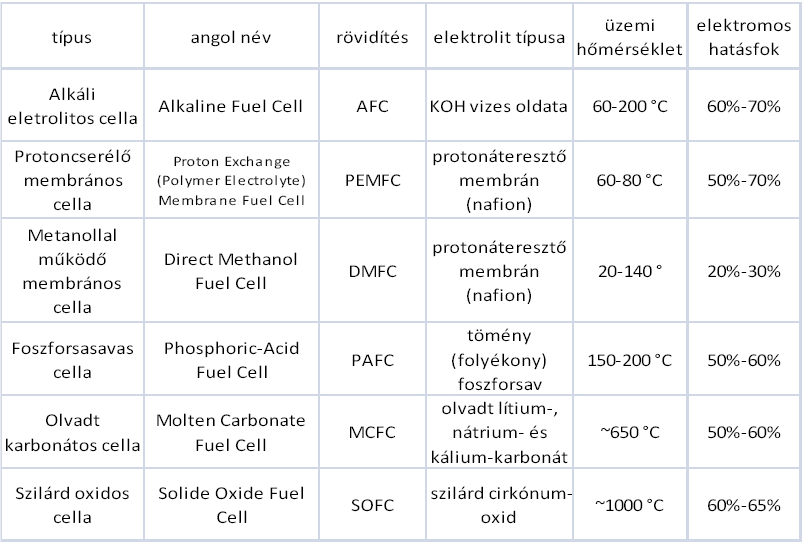
Viszont az egyik legelterjedtebb az alkalmazott elektrolit alapján történő kategorizálás; mi is ezt használjuk a következőkben.
Az alkáli elektrolitos cellák (Alkaline Fuel Cell – AFC) képviselik az egyik leginkább kidolgozott technológiát az üzemanyagcellák között. Már 1960 óta használják őket, többek között a NASA Apollo és Space Shuttle programjaiban is. Az űrjárművek fedélzetén ilyen típusú cellák biztosították a fedélzeti eszközök működéséhez szükséges áramot, valamint az ivóvizet is. Az ilyen típusú üzemanyagcellákat feltalálójuk után Bacon-celláknak is szokták hívni.
Az alkáli elektrolitos cellák esetében a töltéshordozó részecske a hidroxidion (OH-), amely a katódtól az anód felé halad, ahol reakcióba lép a hidrogénnel, amiből víz és elektron keletkezik.
Működési körülmények:
Az elektrolit típusa: pl. 30%-os vizes kálium-hidroxid oldat
Működési hőmérséklet: 80°C alatt
Elektromos hatásfok: 60%–70%
Reakciók:
Anódon: 2H2 + 4OH- → 4H2O + 4e-
Katódon: O2 + 2H2O + 4e- → 4OH-
A teljes reakció: 2H2 + O2 → 2H2O
Előnyei:
- Az egyik legnagyobb elektromos hatásfokú cella
- Nagyon olcsó az előállítása, mivel sokféle elektrolittal képes működni
- Viszonylag alacsony a működési hőmérséklete
- Gyors indulás
Hátrányai:
Nagyon érzékeny a szén-dioxidra, szén-monoxidra és a metánra, mivel ezek reakcióba léphetnek az elektrolittal, ezáltal csökkentve az tüzelőanyag-cella hatékonyságát. A külvilágtól elzárt környezetben érzi igazán jól magát, ahol nem fenyegetik az említett gázok. Működéséhez tiszta hidrogénre és oxigénre van szükség.
Felhasználási területek:
- Tengeralattjárók
- Hajók
- Hadiipar
Az olvadt karbonátos cella (Molten Carbonate Fuel Cell – MCFC) a magas üzemi hőmérsékletű cellák családjába tartozik. A magas üzemi hőmérséklet lehetővé teszi, hogy közvetlenül földgázzal is működtethessük a tüzelőanyag-cellát. Az 1960-as évek közepén fejlesztették ki, és azóta a legnagyobb eredményeket a teljesítmény és az élettartam növelésének tekintetében érték el. Az ilyen típusú cellák a többi cellától eltérő módon működnek. Elektrolitként olvadt karbonát-sókat tartalmaznak, általában két karbonát keverékéből. A két leggyakoribb kombináció: lítium-karbonát és kálium-karbonát keveréke.
A magas üzemi hőmérséklet ahhoz szükséges, hogy az elektrolit megolvadjon, és megfelelő ionáteresztő képességet érjen el. Olvadása után az elektrolit képes lesz arra, hogy vezesse a karbonátionokat (CO32-). Ezek az ionok a katódtól az anód felé haladnak, ahol hidrogénnel egyesülve víz, szén-dioxid és elektron keletkezik. Az elektron pedig egy külső áramkörön keresztül áramot és hőt termelve érkezik vissza a katódra.
Működési körülmények:
Az elektrolit típusa: olvadt lítium-, nátrium- és kálium-karbonát
Működési hőmérséklet: 600°C felett
Elektromos hatásfok: 50%–60%
Reakciók:
Anódon: CO32- + H2 → H2O + CO2 + 2e-
Katódon: CO2 + ½O2 + 2e- → CO32-
A teljes reakció: H2 + ½O2 + CO2 (katód) → H2O + CO2 (anód)
Előnyei:
- A magas működési hőmérséklet miatt nincs szükség üzemanyag-reformerre. Az ilyen tüzelőanyag-cellákat belső reformeres celláknak is nevezik.
- A magas működési hőmérséklet hatékony hőhasznosításra ad lehetőséget
- Olcsó alapanyagok
Hátrányai:
- Érzékeny a korrózióra
- Lassú indulás
- Körülményes a szén-dioxid áramlásának szabályozása
Felhasználási területek:
- Kogenerációs erőművek
- Segédáramforrások
A foszforsavas cellák (Phosphoric Acid Fuel Cell – PAFC) kerültek elsőként kereskedelmi forgalomba az üzemanyagcellák közül. Az 1960-as évek közepén fejlesztették ki ezt a típust, és már a rákövetkező évtizedben sor kerülhetett az első eladásokra. Más üzemanyagcella-típusokhoz képest akkor jóval stabilabb viselkedést mutatott, nagyobb teljesítményre volt képes, és mindezek mellet az ára is elég alacsony volt. E cellákban az elektrolit teljes egészében foszforsavból áll (H3PO4). Mivel a foszforsav ionos vezetése alacsony hőmérsékleten rossz, ezért a működési hőmérsékletük elég magas, gyakran a 200°C-t is meghaladja. A működése nagyjából azonos a protoncsere-membrános celláéval. Ennek megfelelően az anódon és katódon lejátszódó reakciók is azonosak.
Működési körülmények:
Az elektrolit típusa: tömény folyékony foszforsav
Működési hőmérséklet: 150–220°C
Elektromos hatásfok: 50%–60%
Reakciók:
Anódon: 2H2 → 4H+ + 4e-
Katódon: O2 + 4H+ + 4e- → 2H2O
A teljes reakció: 2H2 + O2 → 2H2O
Előnyei:
- A magas működési hőmérséklet hatékony hőhasznosításra ad lehetőséget
- Érzéketlen a szén-dioxidra és a szén-monoxidra
- Hosszú élettartam (a foszforsav illékonysága nagyon alacsony)
- Stabilitás
- Egyszerű felépítés
Hátrányai:
- Nagy méret
- Platinakatalizátor szükséges
- Nehezen indítható (a foszforsav 40 °C alatt szilárd)
Felhasználási területek:
- Épületek energiaellátása
- Erőművek
- Hadiipar
A protoncsere-membrános cella (Proton Exchange Membrane Fuel Cell – PEMFC) lehet a jövőben a legalkalmasabb arra a feladatra, hogy átvegye a mostani dízel- és benzinmotorok szerepét a közlekedésben. Először a NASA használt ilyen típusú cellákat a Gemini-programban az 1960-as években. Az elektród anyaga ezekben a cellákban szilárd polimer membrán (vékony műanyag filmréteg). E polimer jellegzetessége, hogy nedves állapotban a protonokat átereszti, azonban az elektronokat nem.
Az anódon a beáramló hidrogén a katalizátor felületén „szétesik” protonokra és elektronokra. A protonok a membránon keresztül haladnak a katód felé, az elektronok pedig egy külső áramkörön keresztül érik el azt, miközben elektromos energia keletkezik. A katódra érkező elektron az ott beáramló oxigénnel és a membránból érkező hidrogénionokkal egyesül és víz keletkezik.
A többi típusú üzemanyagcellával összehasonlítva sokkal jobb energia-, és teljesítménysűrűségi paraméterekkel rendelkezik. Egyik jellegzetessége, hogy a működési hőmérséklete a membrán anyagától nagymértékben függ. Membránként az egyik leggyakrabban használt anyag, a Nafion® esetében alacsonyabb a működési hőmérséklet, míg polybenzimidazole membrán esetén magasabb, akár a 200 °C-t is meghaladhatja.
Működési körülmények:
Az elektrolit típusa: protonáteresztő membrán
Működési hőmérséklet: 70–220°C
Elektromos hatásfok: 50%-70%
Reakciók:
Anódon: 2H2 → 4H+ + 4e-
Katódon: O2 + 4H+ + 4e- → 2H2O
A teljes reakció: 2H2 + O2 → 2H2O
Előnyei:
- Hatékony
- A szilárd elektrolit miatt nem érzékeny a gravitációra
- Gyors indulás
- Hosszú élettartam
Hátrányai:
- Körülményes szabályozás (az elektrolitot nedvesíteni kell)
- Az alacsony működési hőmérséklet miatt kicsi a hőhasznosítás hatásfoka
- A nemesfémtartalom miatt drága
Felhasználási területek:
- Járműipar
- Hadiipar
- Hordozható áramforrások
- Erőművek
A cellák felépítése
– két elektróda (anód és katód)
– elektrolit vagy membrán
– katalizátor (platina vagy annak ötvözetei)
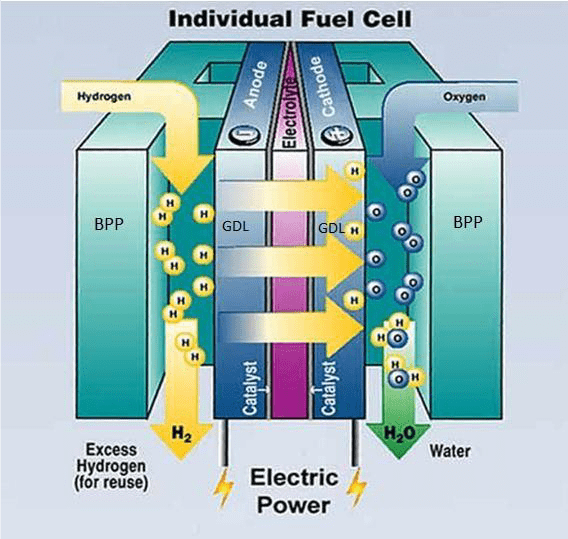
A 3. ábrán látható a tüzelőanyag-cella felépítése. Anódnak nevezzük azt az elektródot, ahol az oxidáció megy végbe, vagyis az ide áramló üzemanyag elektront ad le, míg a katódon redukció (elektronfelvétel) történik. Az elektrolit elszigeteli egymástól a két elektródot, meggátolva a tüzelőanyag és az oxidálószer közvetlen keveredését. Manapság a protonáteresztő membrános cellák terjedtek el, ahol a membrán szerepe az, hogy csak a hidrogén ionokat engedi átáramlani a membránon keresztül. Az elektronok a két elektródot összekötő fémes vezetőn jutnak el az anódtól a katódig. A gázbevezetés és homogén eloszlás segítésére az anód és a katódoldalon grafit gázvezető lapok (BPP – BiPolar Plates) és grafit papír vagy szövet lapok (GDL – Gas Diffusion Layer) szolgálnak. Fogyasztó (pl. elektromotor) beiktatásával, az elektronokkal munkát lehet végeztetni, amelynek nagysága a két elektród közötti potenciálkülönbségtől és az áthaladt töltésmennyiségtől függ. A cella felépítése és működése a következő ábrán látható.
Az elektrolit elektromos szigetelő, de kiváló ionvezető is. A két legfontosabb különbség az egyes tüzelőanyag-cellák típusai között a működési hőmérséklet és az ionos vezetést biztosító elektrolit anyaga.
A PEM cellák működése
Az anódon átvezetett hidrogént a platina katalizátor szétválasztja hidrogénatomokra. Ezután a H+ ionok a membránon keresztül jutnak el a katódhoz. A membránt ezért nevezik protoncserélőnek, mivel csak a hidrogén iont, azaz a protont engedi át, míg a negatív töltésű elektront nem. Az elektronok egy külső fogyasztón keresztül tudnak átjutni a katódba. A katódra vezetett oxigénmolekulák a katalizátor segítségével szintén lebomlanak oxigénatomokra, melyek az anódból átáramló elektronokkal és a membránon átjutott hidrogénionokkal egyesülve vizet hoznak létre.
Tehát a reakciók az elektródákban:
Anód: 2H2 → 4H++4e– (3.1)
Katód: O2+4H++4e– → 2H2O (3.2)
A membrán általában egy szilárd műanyag lemez, amelyet platinával szoktak bevonni. A platina a legjobb katalizátor, viszont drága és ritka fém, ezért a platinát vagy ötvözeteit minél kisebb mennyiségben kell leválasztani a protoncserélő membrán felületére.
Fontos szempont, hogy megfelelő legyen a rendszerben a nedvességtartalom, ugyanis a Nafion típusú membránok ionvezető képessége kis és nagy nedvességtartalom esetén is romlik. Újabban azonban léteznek már „szárazon” is üzemelő membránok. A nedvességtartalom szabályozása befolyással van még az elektródák közötti ozmózis nyomásra is, ugyanis ez határozza meg a membránon keresztüli nedvesség áramlásának irányát, amelynek egybe kell esnie a protonáramlás irányával, mert ellenkező esetben éppen gátolja azt. Másrészről a reakció végterméke is víz, ezért lényeges annak elvezetése. Emiatt érdemes a hőmérsékletet 80-90 °C között tartani, de ebben az esetben a reakciók lassan mennek végbe. A hőmérséklet szabályozása a hűtést és a fűtést is magában foglalja, ugyanis nagyon alacsony hőmérsékleten a membránba fagyott víz gátolja a protonok áramlását.
A tüzelőanyag-cella élettartamát és hatásfokát jelentősen befolyásoló tényező az üzemanyag tisztasága. A platina katalizátort könnyen elszennyezheti az üzemanyagba jutó CO, ezért ennek meg kell felelnie bizonyos tisztasági kritériumoknak. A megengedett szénmonoxid tartalomnak általában 100 ppm alatt kell lennie.
A szemelvények forrása:
Mayer Zoltán és Kriston Ákos – Hidrogén és metanol gazdaság (https://regi.tankonyvtar.hu/hu/tartalom/tamop412A/2010-0017_31_hidrogen_es_metanol/ch01s04.html)